Di antara produk-produk yang ditarik BPOM, ada tiga jenis obat yang membuah heboh masyarakat lantaran dicabut izin edarnya. Padahal obat-obat itu kerap kali digunakan masyarakat setiap harinya.
Dirangkum detikHealth, berikut tiga obat yang ditarik BPOM di tahun 2018.
ADVERTISEMENT
SCROLL TO CONTINUE WITH CONTENT
Baca juga: BPOM RI Tarik Dua Obat Hipertensi! |
Viostin DS dan Enzyplex
|
Foto: Firdaus/detikHealth
|
BPOM di awal bulan Februari membuat gebrakan dengan mencabut izin edar dua produk suplemen produksi PT Pharos Indonesia dengan nomor izin edar (NIE) POM SD.051523771 nomor bets BN C6K994H, dan Enzyplex tablet produksi PT Medifarma Laboratories dengan NIE DBL7214704016A1 nomor bets 16185101. Hal ini dikarenakan kedua sampel produk tersebut terbukti positif mengandung DNA (Deoxyribo Nucleic Acid) babi.
Dalam kasus ini ditemukan indikasi adanya ketidakkonsistenan informasi data pre-market dengan hasil pengawasan post market. Pada awal pendaftaran izin edar produk, kedua produk tersebut mengaku menggunakan bahan baku bersumber sapi.
"Di awal sertifikasi awal LPPOM MUI diidentifikasikan negatif. Tapi saat BPOM melakukan pengawasan post-market ternyata kita temukan tidak sesuai. Sempat ada penarikan sampai akhirnya kami mencabut izin edar Viostin DS dan Enzyplex," kata Ketua BPOM Penny K. Lukito, Senin (5/2/2018),
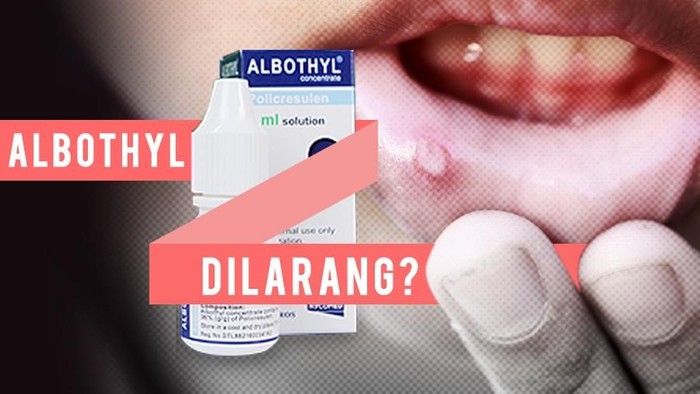
Albothyl
|
Foto: infografis
|
Masih di bulan yang sama, cairan obat yang kerap dijadikan penyembuh sariawan, Albothyl ditarik izin edarnya oleh BPOM. Pasalnya, cairan obat luar konsentrat ini mengandung policresulen 36 persen yang berisiko bagi kesehatan.
"BPOM RI membekukan izin edar Albothyl dalam bentuk cairan obat luar konsentrat hingga perbaikan indikasi yang diajukan disetujui. Untuk produk sejenis akan diberlakukan hal yang sama," tulis BPOM dalam keterangan resminya, Kamis (15/2/2018).
Selain Albothyl, empat produk obat yang juga mengandung policresulen dibekukan izin edarnya. Seperti Medisio, Prescotide, Aptil.
Obat Hipertensi
|
Foto: Thinkstock
|
BPOM pun meminta industri menghentikan produksi dan distribusi obat tersebut. Produk valsartan yang ditarik secara sukarela oleh produsen, adalah Varten Tablet 80 mg dan 160 mg buatan PT Actavis Indonesia dan Valesco Kaplet Salut Selaput 40 mg, 80 mg dan 160 mg buatan PT Dipa Pharmalab Intersains.
Setelah valsartan, pada awal Desember, obat hipertensi golongan angiotensin receptor blocker (ARB) yaitu Irbesartan dan Losartan ditarik dari peredaran di Eropa dan Amerika Serikat. Dalam keterangan yang ada di laman resmi BPOM, dijelaskan bahwa EMA (European Medicines Agency), US FDA (Food and Drug Administration), MHRA (Medicines and Healthcare products Regulatory Agency) dan BPOM RI masih terus melakukan kajian lebih lanjut terhadap bahan baku tersebut karena ditemukan adanya pengotor N-Nitrosodimethylamine (NDMA) dan N-Nitrosodiethylamine (NDEA).
"Berdasarkan penelusuran BPOM RI, obat antihipertensi golongan ARB yang beredar di Indonesia dan terdampak impurities NDMA dan NDEA adalah Losartan dan Valsartan dengan bahan baku produksi Zhejiang Huahai Pharmaceuticals, Linhai, China. Sedangkan Irbesartan yang ditarik oleh US FDA, sumber bahan bakunya tidak digunakan untuk produk obat yang terdaftar di Indonesia," demikian seperti tertera di peringatan publik.